
Ecuación de Nerst
La ecuación de Nernst es utilizada para hallar el potencial de reducción en los electrodos en condiciones diferentes a los estándares. Según (Balderas, 2015) si se quiere estudiar la tendencia de una reacción es preciso conocer el signo y el valor de ΔG (variación de la energía libre de Gibbs) en dichas condiciones. Para obtener dicha información se utiliza la siguiente expresión termodinámica:

Entonces para la reacción aA + bB → cC + dD, Q adopta
la expresión:
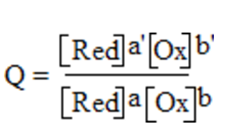
[C] y [D], hacen referencia a las concentraciones molares si se trata de gases o iones en disolución, para los productos de la reacción, en cambio [A] y [B], son también las presiones parciales pero para el caso de los reactivos. Siendo los exponentes, la cantidad de moles que conforma cada sustancia que se encuentra participando en la reacción (conocidos como coeficientes estequiométricos), y a las sustancias que se encuentran en estado sólido se les da una concentración unitaria, por lo cual no aparecen en Q. (Méndez, 2010)
La reacción será
espontánea si ΔG < 0. Como ΔG = -nFE podemos transformar la expresión
anterior de la forma siguiente:

Esta expresión es conocida como la ecuación de Nernst. La forma más utilizada de esta expresión, a 25 ºC, tras sustituir el valor numérico de las constantes es:

El potencial de una reacción redox espontánea es positivo, E > 0, y su ∆G < 0. Para una reacción en equilibrio E = 0 (∆G = 0) y su cociente de reacción, Q, es igual a la constante de equilibrio, K:

Electroquímica en las baterías
Las baterías eléctricas, por medio de una reacción química producen, en su terminal negativo, una gran cantidad de electrones (con carga negativa) y su terminal positiva produce una gran ausencia de electrones (lo que causa que este terminal sea de carga positiva) (Fig. 5)

